Geneettisiä tutkimuksia tehdessämme kohtaamme usein riittämättömiä RNA-näytteitä esimerkiksi pienten anatomisten suukasvaimien tutkimiseen, jopa yksisolunäytteitä ja tiettyjen geenimutaatioiden näytteitä, jotka transkriptoivat erittäin alhaisina ihmissoluissa.Tietysti COVID-19-testiä varten, jos pyyhkäisynäytteet eivät ole oikeassa paikassa tai näytteenoton aikana ei ole tarpeeksi kertaa, otoskoko on hyvin pieni, minkä vuoksi Terveys- ja perhesuunnittelukomissio ilmestyi kaksi päivää sitten ja läpäissyt testin, ja jos nukleiinihapponäytteenottaja ei ottanut kuutta näytettä, voit ilmoittaa siitä.
Reagenssin herkkyys on tärkeä, koska meillä on tämä tai tuo ongelma, joten mitä voimme tehdä parantaaksemme RT-PCR:n herkkyyttä?
Ennen kuin keskustelemme mahdollisista ratkaisuista, mainitaan kaksi suurta ongelmaa juuri mainitsemamme tilanteen kanssa.
Ensinnäkin olemme huolissamme RNA:n häviämisestä, kun näytteessämme on vain muutama solupopulaatio.Jos käytetään perinteisiä erotus- ja puhdistusmenetelmiä, kuten kolonnimenetelmää tai nukleiinihapposaostusmenetelmää, on suuri mahdollisuus, että muutamat näytteet menetetään.Yksi ratkaisu on lisätä kantajamolekyyli, kuten tRNA, mutta silloinkaan ei ole takeita siitä, että palautuskokeemme on kunnossa.
Joten mikä on parempi tapa?Hyvä vaihtoehto viljellyille soluille tai mikroanatomisille näytteille on käyttää suoraa lyysiä.
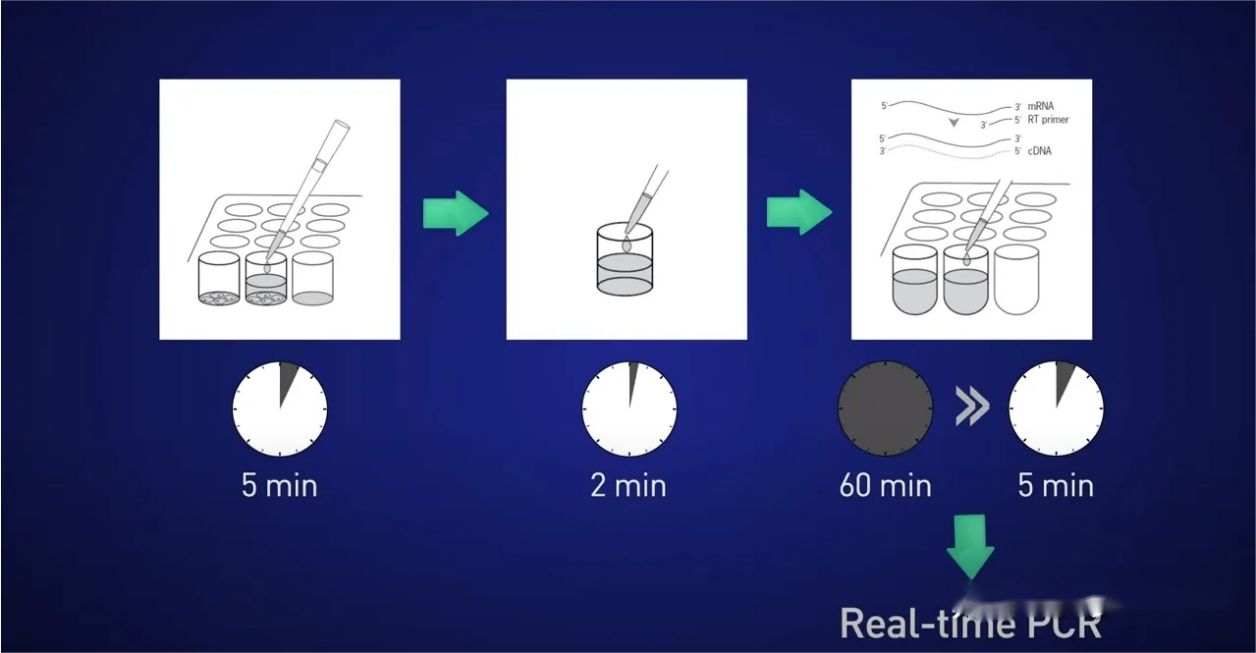
Ajatuksena on jakaa solut 5 minuutiksi, vapauttaa RNA liuokseen, sitten pysäyttää reaktio 2 minuutiksi, sitten lisätä lysaatti suoraan käänteistranskriptioreaktioon, jotta RNA:ta ei menetetä, ja lopuksi laittaa saatu cDNA suoraan. reaaliaikaiseen reaktioon.
Mutta entä jos rajoitetun lähtökohdan tai pienen määrän kohdegeenin ilmentymisen vuoksi voimme kierrättää kaiken RNA:n emmekä silti tarjoa tarpeeksi templaatteja hyvän reaaliaikaisen signaalin saamiseksi?
Tässä tapauksessa esivahvistusvaihe voi olla erittäin hyödyllinen.
Seuraava on kaavio herkkyyden lisäämiseksi käänteistranskription jälkeen.Ennen kuin aloitamme, meidän on kysyttävä alavirtaan, mistä kohteista olemme kiinnostuneita, jotta voimme suunnitella erityisiä alukkeita näille kohteille esivahvistusta varten.
Tämä voidaan saavuttaa luomalla sekoitettu aluke, jossa on jopa 100 paria alukkeita ja 10-14-kertainen reaktiosykli.Siksi tähän vaatimukseen erityisesti suunniteltu Master Mix tarvitaan saadun cDNA:n esiamplifiointiin.
Syklien lukumäärän asettaminen 10 ja 14 välille johtuu siitä, että tämä rajoitettu syklien määrä varmistaa eri kohteiden välisen satunnaisuuden, mikä on ratkaisevan tärkeää kvantitatiivista molekyylitietoa tarvitseville tutkijoille.
Esiamplifikaation jälkeen voimme saada suuren määrän cDNA:ta, joten taustapään havaitsemisherkkyys paranee huomattavasti, ja voimme jopa laimentaa näytettä ja suorittaa useita reaaliaikaisia PCR-reaktioita mahdollisten satunnaisten virheiden eliminoimiseksi.
Postitusaika: 11.4.2023